|
|
|
|
|
Некоторые вопросы интенсификации процесса культивирования коловраток и мелких ветвистоусых ракообразных
Проблема поиска и совершенствования технологической схемы культивирования мелких беспозвоночных, как “стартового” корма для подращивания личинок рыб, несмотря на определенные успехи, не теряет своей актуальности в связи с дальнейшим развитием рыбоводства и переходом на индустриальные методы выращивания рыбы. Подтверждением может служить тот факт, что использование имевшихся разработок по культивированию коловраток и мелких ветвистоусых в производственных масштабах оказалось малоэффективным. В настоящее время трудно назвать рыбоводный завод или специализированный цех по воспроизводству рыб, где было бы организовано промышленное подращивание личинок рыб на культивируемых мелких ракообразных и коловратках.
Не разработана и рецептура искусственных кормов для личинок рыб на первых этапах их постембрионального развития. Попытки же замены живых кормов водородными бактериями, белково-витаминным концентратом и другими кормосмесямн не дали положительных результатов (Баранова, Галкина, Сахаров, 1979; Дементьев, 1979; Кражан и др. 1979). Рискован метод отлова зоопланктона для кормления личинок рыб непосредственно из водоемов. Как справедливо отмечают Л. Я. Алдакимова, Н. Х. Идрисова, Е. И. Аксенова (1979), он не обеспечивает стабильного количества коловраток и мелких ветвистоусых, а в периоды массового развития хищных форм веслоногих может нанести ощутимый вред подращиванию личинок.
Поэтому метод искусственного культивирования беспозвоночных, в частности коловраток и мелких ветвистоуснх ракообразных, остается более надежным и перспективным, особенно в условиях раннего получения личинок. В этом плане, наряду с дальнейшими изысканиями эффективных способов культивирования, предстоит решить ряд организационных вопросов, в первую очередь подготовки квалифицированных кадров.
Проведенные нами исследования были направлены на совершенствование технологической схемы культивирования коловратки Brachionus rubens и ветвистоусого рачка Moina mасгосора. Они наиболее перспективны для промышленного культивирования и скармливания личинкам рыб в первые 12-15 дней жизни последних. Предусматривался поиск новых субстратов и кормовых смесей с целью повышения трофической обеспеченности выращиваемых гидробионтов и оптимизации технологической схемы культивирования брахионуса и моины.
Общие сведения об объектах культивирования
Moina mасгосора Straus (Crustacea, Cladoсera).
Широко paспространенный вид, живет во всех зоогеографических областях. В Молдавии встречается почти повсеместно, однако массового развития достигает в прудах и мелких временных водоемах, особенно если они сильно загрязнены органикой, устойчив к изменению содержания кислорода в воде и степени ее минерализации. О толерантности к повышенному загрязнению свидетельствует массовое развитие в городских очистных сооружениях. В частности, в аэротенках очистных сооружений г. Тирасполя, по нашим наблюдениям, численность Mоina macrocoра достигала 36,0 млн./м³, биомасса — 2,1 кг. Уcтойчив к колебаниям температуры в диапазоне 5-30°. Полная гибель наступает при 41-43° (Аскеров, 1960)..
Характеризуется биологическими особенностями, ценными для массового культивирования. Это один из наиболее быстрорастущих видов ветвистоусых ракообразных, обладающих коротким жизненным циклом и способностью существовать при большой плотности. В естественных условиях самки откладывают до 64 яиц, срок развития которых при температуре 30-35° составляет 1,4-2, а при 20° — 4,8 суток. Достигает половой зрелости при температуре 26,5-28,0° на 2,5-3 сутки. Максимальная продолжительность жизни — 2 месяца. В этот период самки многократно дают пометы, насчитывающие до 30 эмбрионов, с интервалом 2-3 дня.
Питается дрожжами, бактериофлорой и мелкими микроводорослями. Длина самки примерно 1 мм.
Brachionus rubens Еhrenberg (Rotatoria).
Распространен повсеместно в умеренных и южных широтах, часто встречается в массе.
Свободноживущий организм, но только в сильно эвтрофированных водоемах, комменсал на поверхности тела ветвистоусых, что подтвердили проведенные нами опыты с Moina mасгосора (на теле одной моины поселялись до 60 особей брахионуса). В таких случаях у рачков снижается подвижность и полностью прекращается размножение. Поэтому при культивировании моины следует принимать меры, предупреждающие попадание брахионуса в культиваторы.
Брахионус принадлежит к числу наиболее перспективных для массового разведения коловраток. Устойчив к дефициту кислорода в воде, ее органическому загрязнению, к большим колебаниям температуры (оптимум — 25-28°). Обладает высокой скоростью воспроизводства. По данным наших наблюдений, прирост численности от 5 экз. брахионуса в течении 10 дней при температуре 26°С составил в среднем 245 экз. (максимум 295, минимум 199). Продолжительность жизни температуре воды 21-24° — 4-7 дней. За это время самкн откладывают 11-27 яиц.
Активный фильтратор, питается бактериями и мелким фитопланктоном. Длина панциря 154-275, ширина — 110-203 мк.
Поиск новых субстратов и кормовых смесей
Одним из ведущих факторов, определяющих успех культивирования брахионуса и моины, является полное удовлетворение их пищевых потребностей бактериофлорой и микроводорослями, а также обеспечение других благоприятных условий обитания.
До последнего времени для стимуляции развития бактериофлоры в культуральной среде широко использовали кормовые (гидролизные) дрожжи. Однако, как показывает опыт, применение их даже в высоких дозах малоэффективно и нерентабельно. В связи с этим, одной из первоочередных задач наших исследований был поиск новых субстратов и кормовых смесей и выяснение их оптимального соотношения. Проверяли эффективность использования кормовых дрожжей, обогащенных 6% лизином, глютена кукурузного сухого, сухих каротиноидных дрожжей, кукурузного экстракта в хлореллы. Все они, за исключением хлореллы, — хорошие стимуляторы развития бактериофлоры в культуральной среде. Не исключена возможность регенерации части клеток дрожжей, которые могли быть использованы непосредственно в питании культивируемыми гидробионтами.
Используемый кукурузный экстракт содержит примерно 40% действующего вещества. В глютене кукурузном сухом примерно 50% протеина, биологическая ценность которого по индексу незаменимых кислот теоретически составляет 57% (Горбатенький, Коварский, Бодрова 1979).
Проблема добавок хлореллы и других видов протококковых водорослей в рацион культивируемых видов коловраток и ветвистоусых не нова. Известно, что еще Н. С. Гаевская (1941) на примере дафний, убедительно показала эффективность протококковых водорослей в качестве добавок к бактериально-дрожжевой смеси. Это подтвердилось исследованиями, проводившимися в последние годы на других видах беспозвоночных. Тем не менее нормативы оптимальной концентрации хлореллы в культуральной среде на различных этапах культивирования того или иного вида безпозвоночных отсутствуют. Произвольное применение повышенных концентраций хлореллы может привести к перенасыщению культуральной среды кислородом и гибели рачков вод влиянием токсичности продуктов ее жизнедеятельности. В этом отношении особенно опасны стареющие культуры хлореллы, выделяющие антибиотик хлораллин, подавляющий не только развитие дафнии, но развитие самой хлореллы. Дафнии на таких культурах растут медленно, живут всего 11-13 дней и погибают, не достигнув половозрлости. (Богатова, 1971; Антипчук, Кражан, Литвинова, Мущак, 1979).Установлено также, что не все виды и штаммы хлореллы пригодны для скармливания беспозвоночным.
Мы использовали культуры местного штамма Chlorella vulgaris, биотехника культивирования которого разработана в лаборатории экологии водных беспозвоночных Института зоологии и физиологии АН МССР.
Первоначально проверяли эффективность следующих кормовых смесей (пищевых субстратов): кормовые дрожжи (25%) + глютен (75%) + хлорелла; кормовые дрожжи (60%) + глютен (20%) + биокомплекс (20%) + хлорелла; кормовые дрожжи (80%) + глютен (20%) + хлорелла; кормовые дрожжи (100%) + хлорелла.
Один вариант опыта проводили на чистой культуре хлореллы, другой — на глютене. Контролем служили те же кормосмеси, но 6eз примеси хлореллы. За критерии полноценности кормовых смесей принимали продолжительность жизни Daphnia magna и Ceriodaphnia affiniа, сроки достижения ими половозрелости, количество выводков в течении жизни и общую плодовитость. Рачков кормили из расчета 10 мг/ кормосмеси и 1,2-2,0 млн.кл/мл хлореллы.
Проведенный опыт позволил выделить как наиболее полноценную кормосмесь № 2. В этом отношении показательны данные, приведении в табл.1. Аналогичное подтвердилось и в опытах с цериодафнией. Заслуживает внимания вариант, в котором дафний содержали на смеси кормовых дрожжей с хлореллой. По всем принятым показателям они практически не уступали особям предыдущего варианта. Это позволило нам использовать данную смесь в дальнейшей работе.
Таблица 1
Эффективность использования различных кормосмесей
| Вариант | продолжи- тельность жизни,дн. |
кол-во выводков, шт. |
общая плодови - тость |
|
| Daphnia magna | ||||
| опыт | Смесь №1+хлорелла | 51 | 16 | 864 |
| Смесь №2+хлорелла | 55 | 17 | 1007 | |
| Смесь №3+хлорелла | 49 | 15 | 875 | |
| Кормовые дрожжи + хлорелла |
51 | 16 | 958 | |
| контроль | Хлорелла | 55 | 16 | 757 |
| Глютен | 26 | 10 | 116 | |
| Смесь №1+хлорелла | 40 | 7 | 238 | |
| Смесь №2+хлорелла | 26 | 9 | 202 | |
| Смесь №3+хлорелла | 34 | 9 | 240 | |
| Кормовые дрожжи | 33 | 6 | 233 | |
| Ceriodaphnia affinis | ||||
| опыт | Смесь №1+хлорелла | 19 | 8 | 78 |
| Смесь №2+хлорелла | 23 | 8 | 89 | |
| Смесь №3+хлорелла | 14 | 5 | 44 | |
| Кормовые дрожжи + хлорелла |
19 | 7 | 73 | |
| контроль | Хлорелла | 16 | 4 | 25 |
| Смесь №1 | 27 | 9 | 48 | |
| Смесь №2 | 26 | 9 | 61 | |
| Кормовые дрожжи | 27 | 10 | 60 | |
Насколько существенна роль хлореллы при культивировании ветвистоусых видно из результатов контрольных вариантов. При использовании всех трех смесей, без примеси хлореллы, продолжительность жизни дафний, количество выводков и общая их плодовитость заметно уступали таковым в вариантах. Более высокие показатели получены в варианте с кормлением дафний чистой культурой хлореллы. Не oправдало себя кормление дафний и одними дрожжами (табл. 1). Эти результаты подтвердились в опытах с мойной и брахионусом. Например, прирост общей численности моины при кормлении одними дрожками был в 8,4, а брахионуса — в 22 раза ниже, чем в варианте кормления гидролизными дрожжами с примесью хлореллы. В обоих случаях дрожжи вносили из расчета 10 мг/л, а хлореллу — 1,5-2,0 млн.кл/мл. Близкие результаты дало использование одних каратиноидных дрожжей для культивирования моины (табл.2). В этом случае ее суммарная биомасса была в 4,5 раза ниже, чем в условиях кормления каратиноидными дрожжами (5 мг/л) и хлореллой (1,5-2,0 млн. кл/мл).
Таблица 2
Выход биомассы моины в опытах с катариноидными дрожжами, г/м³
| дни съема |
Каратиноидные дрожжи |
Каратиноидные дрожжи + хлорелла |
| 1 | 44,0 | 100,0 |
| 2 | 22,0 | 122,5 |
| 3 | 30,0 | 77,5 |
| 4 | 10,0 | 60,0 |
| 5 | 20,0 | 100,0 |
| 6 | 12,5 | 50,0 |
| 7 | 9,0 | 55,0 |
| 8 | 9,0 | 55,0 |
| 9 | 5,0 | 40,0 |
| 10 | 13,3 | 116,6 |
Помимо всего, с хлореллой в культиваторы вносится масса микроорганизмов (до 650 млн.кл/мл) (Пименова, Максимова, Балицкая, 1962), что также положительно отражается на трофической обеспеченности культивируемого объекта.
Предпринимали попытки выяснить действие каждого из компонентов предложенных стимуляторов на рост микрофлоры. Количественный ее учет проводили в водных эмульсиях до внесения их в культиваторы, а также непосредственно в культуральной среде в период культивирования моины.
Для приготовления водной эмульсии дневную дозу стимулятора, рассчитанную на весь объем культиватора (40 л), разбавляли в 100 мл воды и выдерживали 22-24 ч.
Установлено, что в водных эмульсиях, приготовленных из гидролизных дрожжей из расчета 10-12 мг/л, общее число бактерий, через 24-26 часов составляло в среднем 0,6 млн.кл/мл. Не менее эффективными стимуляторами оказались кукурузный экстракт и каратиноидные дрожжи, несмотря на то, что дозировки каждого из них были в 2 раза ниже. Например, в водных эмульсиях кукурузного экстракта, приготовленных из расчета 5 мг/л численность бактерий достигала 0,5, а каратиноидных дрожжей (5 мг/л) — 0,4 млн.кл/мл. Внесение их в культуральную среду позволяло поддерживать трофическую обеспеченность брахионуса и моины на достаточно высоком уровне. Например, уже в 1-й день культивирования моины после внесения кормосмеси в культиваторы общее число бактерий составляло 116,8-119,7 млн. кл/мл. На 7-й день ее культивирования численность их примерно удвоилась (206,1-290,4 млн.кл/мл). Такой же уровень развития бактериофлоры (в среднем 223,7 млн.) сохранился и на 11-й день опыта несмотря на то, что общая биомасса моины к этому времени увеличилась в 13,6 раза.
Мы не проводили учета бактериофлоры в опытах по культивированию брахионуса, предполагая, что количественный уровень его развития не должен сильно отличаться от вышеприведенного. На основании полученных результатов установлено, что для стимуляции роста бактериофлоры при культивировании брахионуса и моины наиболее рационально использовать смеси из кормовых (гидролизных) дрожжей, обогащенных 6%-ным лизином, из расчета 10 мг/л, кукурузного экстракта — 5 мг/л, каратиноидных дрожжей — 5 мг/л и хлореллы — 1,5-2,0 млн.кл/мл. Каждый компонент необходимо замачивать за 20-24 часа до внесения в культиваторы, хлореллу добавлять ежедневно в свежем виде.
Оптимизация технологической схемы
Получение маточных культур.
Маточные культуры моины и брахионуса наиболее целесообразно готовить раздельно. Мы применяли высушенные покоящиеся яйца обоих видов, заготовленные заблаговременно. Как показал опыт, эфиппии или покоящиеся яйца после высушивания при температуре 35-40° сохраняют жизнеспособность минимум 2 года. Это позволяет работать с одним и тем же клоном, воспитанным в условиях предложенной нами схемы культивирования.
Необходимо уделять особое внимание заготовке покоящихся яиц ветвистоуснх рачков и коловраток в специализированных цехах по их культивированию, как исходному материалу для проведения последующих работ. Для этих целей в сосудах объемом не менее 3-5 л (можно и в 50-60-литровых аквариумах) создают насыщенную чистую культуру коловратки или рачка. Когда популяция достигает высокой плотности, резко ухудшают условия содержания (прекращают кормление, снижают температуру среды), что приводит в последующие 2-3 дня к образованию эфиппий у ветвистоуснх и амиктических самок у коловраток. Осадок фильтруют (каждый вид в отдельности) через густую ткань, затем переносят в чашку Петри, где раскладывают тонким слоем и высушивают при температуре 35-40°. Фильтрат помещают в бюксы, этикетируют и хранят в сухом виде.
Для получения исходной культуры того или иного вида, небольшое количество покоящихся яиц (5-10 мг) вносят в стаканы с водой объемом 50 мл, которые помещаются в сушильный шкаф с температурой 24-26°С. Период развития яиц обоих видов — примерно 3-4 дня. За день до выклева молоди, для удовлетворения ее пищевых потребностей, в стаканы вносят культуру хлореллы из расчета 2-2,5 млн.кл/мл. Молодь рассаживают первоначально в небольшие сосуды (100-150 мл), а по мере роста численности, в зависимости от потребностей цеха в маточной культуре, переносят в большие емкости. Исходный материал для приготовления маточной культуры можно получить и путем отлова в прудах, водохранилищах и других водоемах. Наиболее рационально использовать воду из естественного водоема. Она должна отвечать
санитарно-гидрохимическим требованиям. Для освобождения воды oт простейших, мелких коловраток и их яиц, проходящих через самую густую ткань, целесообразно предварительно ее подогреть до 55-60°, а затем охладить до необходимого уровня. Таким образом обеспечивается сохранение маточных культур в относительно чистой среде не менее 5-7 дней, т.е. периода достижение предельной концентрации.
Чем выше начальная плотность гидробионта при подготовке маточной культуры, тем меньше время ее созревания. Это позволяет готовить маточные культуры в предельно сжатые сроки. Концентрация моины к концу подготовки должна достигнуть 7-8, брахионуса — 120-130 экз./мл.
Растянутый период приготовления маточных культур приводят к неизбежному их засорению мелкими простейшими (циклидиум, еуплотес и стилонихия)и коловратками (ротария, лепаделла, лекане), которые обостряют пищевую конкуренцию и загрязняют культуральную среду продуктами метаболизма. Все это приводит к угнетению маточной культуры основных объектов, снижению их плодовитости, появлению самцов, эфиппиальных самок моины и амиктических — брахионуса, а в итоге к потере культуры.
В процессе подготовки маточных культур, в целях равномерной обеспеченности пищевых потребностей культивируемых гидробионтов, суточную норму корма вносили в культиваторы в 4 приема с б до 23 ч.
Режим температуры и кормления.
Одним на первостепенных условий, обеспечивающих успешное культивирование брахионуса и моины, является температура культуральной среды. В руководствах по разведению коловраток и ветвистоусых ракообразных оптимальной считается 24-26°С. Учитывая высокую толерантность Вгасhionus и Moina mасгосора к температуре среды обитания, мы работали в диапазоне 26-28,0°C. Экспериментальные данные и опытно-производственная проверка показали, что такие температурные пределы обеспечивали наиболее высокий прирост биомассы обоих видов гидробионтов, поэтому мы предлагаем включить их в технологическую oxei культивирования брахионуса и моины.
Естественно, что более интенсивный прирост биомассы брахионуса я моины, происходящий о повышением температуры в культиватоpax на 1,5-2,0°, потребовал внести некоторые коррективы в режим их кормления. К сожалению, этому важному вопросу до последнего времени не уделялось должного внимания. Показательны в этом отношении приведенные в литературе примеры кормления культивируемых гидробионтов от одного раза в 4-5 дней до 12 раз в сутки.
Мы практиковали кормление моины и брахионуса в 4 приема (6.30-7.00, 11.30-12.00, 17.30-18.00, 20.00-22.30). Благодаря этому трофические потребности культивируемого объекта удовлетворялись течение суток равномерно, что в целом положительно отразилось на результатах культивирования. При автоматизации процесса кормление следует проводить 6 раз в интервале от 6.00-24.00, т.е. каждые 4 часа.
В связи с большой насыщенностью культуральной среды органикой обязательным условием культивирования является многократная ее аэрация (15-20 мин. каждые 3 ч) распылением струи воздуха по дну культиватора. Это способствует не только обогащению культуральной среды кислородом, но и ее перемешиванию. Технически аэрация культиваторов может осуществляться по-разному. Мы пользовались аквариальным микрокомпрессором BK-I, вполне обеспечивавшим аэрацию 0,5 м3 среды.
Продолжительность процесса культивирования при разовой зарядке культиваторов брахионусом или моиной не должна превышать 14-16 дней (5-6 дней — накопительный период и 9-10 — ежедневные съемы продукции). Более длительное время содержать культуры нерационально. Подобно маточным культурам они засоряются, иногда в массе, мелкими простейшими и коловратками, несмотря на самое тщательное фильтрование воды. Для частичного удаления их и продуктов метаболизма, накапливающихся в избытке в культуральной среде, целесообразно практиковать замену одной трети объема культиваторов свежей средой во время каждого третьего съема биомассы. Заряжать культиваторы маточными культурами следует с таким расчетом, чтобы на накопительный период затрачивался минимум времени. Мы исходили из расчета не менее 20-25 г/м³ брахионуса и 60-70 г/м³ моины.
За двое суток до внесения маточной культуры, культиватора заливали отстоянной и процеженной через шелковый газ (№68) водой, что предотвращало попадание в культиваторы крупных гидробионтов. В это жe время подавали кормовую смесь, ко дню внесения маточной культуры создававшую благоприятные трофические условия. Хлореллу вводили в культиваторы зa день до маточной культуры. Если поддерживать в них условия, соответствующие параметру предлагаемой схемы культивирования, период достижения максимального уровня развития и брахионуса, и моины можно сократить до 5-6 дней.
Вышеописанные кормовые смеси и технологические приемы культивирования брахионуса и моины испытывали как в лабораторных опытах, так и в полупроизводственных условиях.
Опыты проводили в 40-60-литровых аквариумах на отстоянной водопроводной воде. Маточную культуру, моины интродуцировали из расчета 32,0-44,6 г/м³ (табл.3), брахионуса — 18,0-20,0 г/м³ (табл.4). Температуру культуральной среды поддерживали в пределах 26,0-28,0 С. Барботаж культуры — непрерывный. Кормление — 3 раза в день. Биомассу брахионуса в культиваторах устанавливали расчетным путем, перемножая вес одной особи (0,002 мг) на количество особей в oдном миллилитре. Таким же способом рассчитывали биомассу моины.
Вес (V) разноразмерных групп определяли по уравнению, приведенному Н. М. Крючковой, В. Г. Кондратюк (1961), Л. А. Лебедевой (1968), ![]() (а = 0,0081; b = 3,0; l — длина тела, мм).
(а = 0,0081; b = 3,0; l — длина тела, мм).
Биомассу моины определяли также непосредственным взвешиванием фильтрата после доведения его до условно сырого состояния.
Таблица 3
Динамика биомассы моины в различных условиях культивирования
| Параметры культивирования | варианты кормосмеси | |||
| I | II | III | ||
| Температура °C | 26-28 | 26-28 | 26-28 | |
| Биомасса маточной культуры при зарядке культиваторов, г/м³ | 32,0 | 44,6 | 37,6 | |
| Время накопительного периода культуры, дни | 7 | 4 | 5 | |
| Величины биомассы рачка в культиваторах в дни ее съема, г/м³ | 1 | 420,0 | 365,0 | 377,0 |
| 2 | 408,5 | 315,0 | 341,0 | |
| 3 | 375,0 | 247,0 | 298,0 | |
| 4 | 362,0 | 272,0 | 287,0 | |
| 5 | 343,0 | 237,0 | 265,0 | |
| 6 | 320,0 | 292,0 | 343,0 | |
| 7 | 328,0 | 218,0 | 275,0 | |
| 8 | 315,0 | 235,0 | 238,0 | |
| 9 | - | 227,0 | 261,0 | |
| Среднесуточная биомасса, г/м³ | 358,9 | 267,5 | 298,3 | |
| Среднесуточный прирост биомассы, % от общей величины | 46,1 | 41,6 | 41,7 | |
Примечание: I – гидролизные дрожжи – 10 мг/л; каротиновые дрожжи – 5 мг/л; кукурузный экстракт – 5 мг/л; хлорелла – 2,0 млн.кл/мл; II – гидролизные дрожжи – 10 мг/л; кукурузный экстракт – 10 мг/л; хлорелла – 1,5-2,0 млн.кл/мл; III – гидролизные дрожжи – 10 мг/л; кукурузный экстракт – 20 мг/л; хлорелла – 1,5-2,0 млн.кл/мл.
Как видно из данных табл.3, более высокие показатели биомассы (в среднем 358,9 г/м3) получены в варианте, где в качестве кормовых субстратов использовали все три компонента предлагаемой кормосмеси. При этом следует учесть, что исходное состояние культуры в данной варианте было заметно ниже, чем в остальных двух, чем, по-видимому, объясняется и более продолжительный накопительный период культуры до достижения стационарной фазы. Однако, более удовлетворительная трофическая обеспеченность культуры способствовала более высокому темпу прироста продукции, равному в этой серии опытов в среднем 46,1% от общей биомассы моины, при максимуме 49,4 и минимуме 37,7%.
Во втором варианте опытов из состава кормосмеси были изъяты каратиноидные дрожжи, которые компенсировали повышением концентрации кукурузного экстракта до 10 мг/л. Кроме того, биомасса маточной культуры моины при зарядке культиваторов составляла 44,6 г/м³. Несмотря на это, среднесуточная биомасса равнялась всего 367,5г/м³, что примерно в 1,3 раза ниже, чем в предыдущем варианте.
В третьем варианте увеличили концентрацию кукурузного экстракта до 20 мг/л, но уменьшили вес маточной культуры при зарядке культиваторов до 37,5 г/м³. В результате среднесуточная биомасса моины повысилась до 298,3 г/м³.
Таблица 4
Динамика биомассы брахионуса в различных условиях культивирования
| Параметры культивирования | варианты кормосмеси | ||
| I | II | ||
| Температура °C | 26-28 | 26-28 | |
| Биомасса маточной культуры при зарядке культиваторов, г/м³ | 18,0 | 20,0 | |
| Время накопительного периода культуры, дни | 5 | 5 | |
| Величины биомассы брахионуса в культиваторах в дни ее съема, г/м³ | 1 | 220,0 | 204,0 |
| 2 | 222,0 | 236,0 | |
| 3 | 202,0 | 186,0 | |
| 4 | 192,0 | 116,0 | |
| 5 | 180,0 | 102,0 | |
| 6 | 186,7 | 100,0 | |
| 7 | 168,4 | - | |
| 8 | 168,5 | - | |
| Среднесуточная биомасса, г/м³ | 192,0 | 157,0 | |
| Среднесуточный прирост биомассы, % от общей биомассы | 44,6 | 36,6 | |
Примечание: I – гидролизные дрожжи – 10 мг/л; кукурузный экстракт – 5 мг/л; каратиновые дрожжи – 5 мг/л; хлорелла – 1,5-2,0 млн.кл/мл; II – гидролизные дрожжи – 10 мг/л; кукурузный экстракт – 20 мг/л; хлорелла – 1,5-2,0 млн.кл/мл.
В опытах с брахионусом получены сходные результаты. Как видно из табл.4, более высокая биомасса (в среднем 192,0 г/м³) также была зарегистрирована при использовании всех 4 компонентов предложенной кормосмеси. И в данном случае исходная биомасса маточной культуры была ниже (18 г/м³), чем во втором варианте опыта. По-видимому повышенная трофическая обеспеченность брахионуса и обусловила более интенсивный темп продуцирования, составивший в среднем 44,6% от общей биомассы. В условиях более высокой исходной биомассы брахионуса (20 г/м³), но в отсутствии каратиноидных дрожжей, темп продуцирования биомассы снизился в среднем за сутки до 36,6% от общей биомассы, что не могло не oтразиться и на величинах биомассы в целом.
В 1978 г., например, величины биомассы брахионуса лишь в конце культивирования возросли до 125-135 г/м³. В первые же 7 дней стационарной фазы они не превышали 75,0 г/м³ (рис.1).
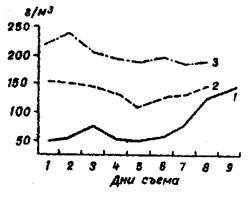
Рис. 1. Динамика биомассы Brachionus rubuns в культиваторах в дни съема. 1 – 1978 г.; 2 – 1979 г.; 3 – 1980 г.
В следующем 1979 г. среднесуточная биомасса 6paxuонуса в культиваторах повысилась по сравнению с 1978 г. в 1,8 раза, равняясь 132,0 г/м³, а ее динамика в период стационарной фазы изменялась в небольших пределах. В 1980 г. среднесуточная биомасса брахионуса достигла 157,0 г/м³. В динамике наблюдался неуклонный спад с 220-240 г/м³ в первые дни стационарной фазы до 170 г/м³ к концу ее.
Примерно аналогичная картина наблюдалась и при испытании схемы с моиной (рис. 2).
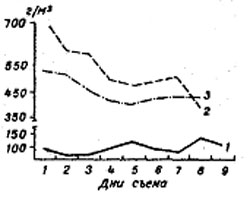
Рис.2. Динамика биомассы Moina macrocopa в культиваторах в дни съема. 1 – 1978 г.; 2 – 1979 г.; 3 – 1980 г.
Среднесуточная ее биомасса в культиваторах составляла 454,0-511,0 г/м³. В первые дни стационарной фазы биомасса моины достигала наиболее высоких показателей — 475,0-485,0 г/м³ в 1980 г. и 570,0-725,0 г/м³ в 1979 г.
Неуклонное снижение биомассы в культиваторах, по мере ее изъятия, по-видимому связано не только со “старением” самой культуры, но и с накоплением в культуральной среде продуктов метаболизма и сопутствующих мелких гидробионтов. По нашим подсчетам, биомасса их в культиваторах на 8-9-й день стационарной фазы, несмотря на принятые меры предосторожности, достигала 86,0-97,0 г/м³. К сожалению, способ изъятия этих мелких кормовых организмов с целью использования для подращивания личинок рыб на первых этапах их постэмбрионального развития не разработан.
Очевидно, для более рационального использования культиваторов необходимо изменить схему культивирования. Вместо проводимых ежедневных съемов части биомассы из всех культиваторов в период стационарной фазы предлагается доводить культуру до предельно возможной насыщенности и полностью ее отлавливать. Количество необходимых для эксплуатации культиваторов будет определяться ежедневными потребностями в живом корме.
ЛИТЕРАТУРА
Аскеров М. К. Биотехника разведения живых кормов на Куринском экспериментальном осетровом заводе. — В кн.: Материалы совещания по вопросам рыбоводства. М., 1960.
Аксенова Е. И., Алдакимова А. Я., Идрисова Н. Х. Перспективы индустриального разведения живых кормов в рыбоводстве. — В кн.: Материалы Всесоюзной научной конференции по направлению и интенсификации рыбоводства во внутренних водоемах Северного Кавказа. М., 1979.
Антипчук А. Ф., Кражан С. А., Литвинова П. А., Мущак П. А. Использование хлореллы при выращивании ветвистоусых ракообразных (Daphnia magna) в замкнутых системах. — Рыбное хозяйство, 1979, №28.
Баранова В. П., Галкина З. И., Сахаров A. M. Испытание белково-витаминных концентратов в качестве корма для личинок карпа, кн.: Выращивание молоди рыб на теплых водах. Л., 1979.
Богатова И. Б., Тагирова Н. А., Овинникова В. В. Руководство по мышленному культивированию в садках планктонных животных кормления личинок и молоди рыб. — М., 1975.
Богатова И. Б. Питание и пищевые взаимоотношения массовых форм прудового зоопланктона. — Вопросы прудового рыбоводства. 1971 т. ХУII.
Гаевская Н. С. 0 методах выращивания живого корма для рыб. Труды Моск.техн.ин-та рыб.пром. и хоз-ва, 1941, вып. 3.
Горбатенький Г. Г., Коварский В. А., Бодрова Э. П. О питательности кормового препарата глютен кукурузный сухой. — Изв. АН МССР, Сер. биол.и хим.наук, 1979, № 5.
Дементьев М. С. Применение сухих кормосмесей для кормления личин рыб. — Материалы Всесоюзной научной конференции по направлению и интенсификации рыбоводства во внутренних водоемах Северного Кавказа. М., 1979.
Кражан С. А., Антипчук А. Ф., Литвинова Т. Г. Опыт культивирования Daphnia magna Straus на комбикорме и гидролизных дрожжах. Рыбное хозяйство, 1979, № 29.
Крючкова Н. М., Кондратюк В. Г. Зависимость фильтрационного питания от температуры у некоторых представителей отряда витвистоусых ракообразных. ДАН БССР, 1966, 10, 2.
Лебедева Л. А. Рост, размножение и продукция кдадоцер водохранилища: Автореф. Дис…. канд.биол.наук. — М., 1968.
Пименова М. Н., Максимова Н. И., Балицкая P. M. Некоторые данные по составу сопутствующей микрофлоры при массовом культивировании водорослей в открытых бассейнах. — Микробиология, 1962, том 31, вып.2.
© 1983. Авторские права на статью принадлежат А.И.Набережному, С.Г.Ирмашевой (Ин-т зоологии и физиологии АН МССР)
Использование и копирование статьи разрешается с указанием автора и ссылкой на первоисточник HERALD HYDROBIOLOGY
Related posts:
- Кормление двухлеток карпа при садковом выращивании Для карпа, так же как и для других безжелудочных рыб,...
- Вырастные пруды В 1972 г. на пяти вырастных прудах рыбхоза Гура-Быкулуй общей...
- Питание судака Исследования питания судака проводились в Дубоссарском водохранилище, Кангазском и Кишкаренском...